Suelo decir muy a menudo que una de las cosas más problemáticas del trabajo en bioquímica o biología molecular es que manejamos cosas que no se ven. Por tanto, el avance de estas disciplinas ha venido de la mano de un desarrollo tecnológico basado en mejorar y facilitar la forma de detectar, observar y cuantificar moléculas. Uno de estos métodos es la tinción, que obviamente se basa en un principio tan básico como pueda ser pintar de algún modo estas cosas tan difíciles de ver, para dotarlas de una coloración que las resalte de modo parecido a como toda la vida se ha hecho para detectar a las personas invisibles (Figura 1).
El objetivo de esta entrada era detallar algunas curiosidades acerca de
los nombres de tinciones muy populares en este tipo de laboratorios,
pero como este blog científico-lúdico es frecuentado por gente de toda
índole y condición, conviene hacer antes algunas aclaraciones
didácticas. ¡Jindetrés, sal!, siempre al servicio de la educación y el conocimiento gratuito y accesible.
Figura 1. Wilhelmina Murray se adelanta unas cuantas décadas y desarrolla un sutil método de detección de hombres invisibles, anticipándose a la moderna colorimetría, en La Liga de los Hombres Extraordinarios, Vol. 1, de Alan Moore y Kevin O'Neill.
De lo que vamos a hablar hoy en particular es de proteínas. Se trata de un tipo de moléculas de lo más diverso en términos de estructura y función: para la mayoría de la gente las proteínas se encuentran en los alimentos (y en los botecitos que venden en los gimansios) y constituyen los "ladrillos" de nuestro organismo, pues forman mayoritariamente nuestros músculos, nuestra piel, cabellos y uñas. Es cierto, pero además hay muchísimos tipos de proteínas capaces de las funciones más increíbles, solas o en compañía; generalmente suelen asociarse entre ellas. Gracias a esta versatilidad también se han convertido en una herramienta crucial en biología molecular. Pero de eso hablaremos en otro momento.
Para un laboratorio enfocado hacia al área de la biomedicina, estudiar las proteínas es crítico si se quiere conocer las bases químicas de una enfermedad: se habla siempre de genes mutados como origen de ciertas patologías, pero no debemos olvidar que detrás de cada gen hay (como poco) una proteína. Así que mayoritariamente estudiamos genes, proteínas, y sus funciones. Pues bien, aunque a simple vista las proteínas no se ven, se pueden aislar con relativa facilidad y manejar de una forma controlada para estudiar sus propiedades. Y entre las técnicas más específicas (que detectan proteínas concretas mediante anticuerpos), o las complejas e informatizadas estrategias de dilucidación de estructuras (mediante cristalografía de rayos X o resonancia magnética nuclear, perdón, nucelar), nos encontramos con atajos más o menos burdos que consisten en aprovechar las características químicas comunes a todas las proteínas para detectar su presencia y poder, de un vistazo, saber sencillamente si nuestra estrategia de aislamiento (purificación, lo llamamos) ha salido correctamente, o por ejemplo qué cantidad de proteínas totales tenemos en una muestra heterogénea. Muchas de estas técnicas* se basan en la producción de una coloración que se puede medir, y así llegamos por fin a los colorines y sus curiosos nombres, que al fin y al cabo ha sido lo que ha disparado este post y lo que además puede interesar a los lectores más moleculosos; al menos a mí me ha resultado sorprendente saber el origen de dichos nombres...
* recomiendo encarecidamente al lector interesado en profundizar en este tema, la lectura del artículo de nuestro compañero Banchsinger en el último número de JoF.
Tinción de Coomassie, más azul que los pitufos
Empezamos por mi favorito (para algo es mi blog, ¿no?), una preciosa coloración azul eléctrico que se utiliza para teñir los geles de acrilamida. No se trata de geles como los de la ducha; al igual que los de agarosa (que ya explicamos aquí) y simplificando, se trata de un material gelatinoso y poroso: macromolecularmente (es decir, "a ojo") es una gelatina transparente; micromolecularmente, al ser poroso permite que a su través se filtren las distintas proteínas de una muestra cuando las hacemos circular aplicando una corriente eléctrica. Y poroso son tan útiles. Perdón. Bueno, en estos geles separamos las proteínas y sin entrar en detalles (esto lo explicaremos en un post más específico que tengo pendiente desde hace mucho tiempo), estas se dispondrán a lo largo de la línea vertical del gel. Como resultado, distintas "columnas"; en cada una de ellas, una o varias proteínas concentradas en distintas alturas (esto es en función de su tamaño). El Coomassie es una de las tinciones que se utilizan sobre el gel completo, se llena una cubeta con la solución y se mete el gel dentro, se tiene meneando un ratito, y luego se quita el colorante quedando un precioso gel de color azulito azulado azuloso. Entonces desteñimos con una solución de igual composición, con la excepción del colorante: metanol (no confundir con el etanol, este es peligroso y cancerígeno) y ácido acético, maloliente (es el componente del vinagre, pero concentrado y puro). Esto sirve para eliminar el exceso de colorante, pero quedan unas banditas que retienen el colorcito azul. Y ahí tenemos nuestras proteínas. El resultado final queda tal que así:
Figura 2. Gel de policarilamida teñido con azul Coomassie. La tercera columna muestra un conjunto de proteínas de tamaños conocidos, a modo de patrón; a la izquierda, muestras de proteínas purificadas. Al existir una sola banda y además con un tamaño coincidente con el esperado, deducimos que el proceso ha resultado satisfactorio. A la derecha, a modo de semi-cuantificación, tenemos cantidades crecientes de proteína control.
Esta coloración es poco analítica, lo cual quiere decir que sólo sirve si tenemos una cantidad importante de proteína. Por tanto, se usa principalmente (o al menos así la uso yo) para comprobar procesos de purificación de proteínas (ver Figura 2), donde las cantidades que se manejan son grandes (en nuestro mundillo, "grande" significa microgramos, es decir, millonésimas de gramos. Ojito).
Pero, ¿cómo funciona el Coomassie?
Debemos matizar que el nombre "oficial" del colorante es Coomassie Brilliant Blue
(lo que para un británico vendría a decir algo así como "un azul
cojonudo"). Por este nombre se identifican dos sustancias químicamente muy parecidas, que se distinguen como G-250 y R-250 (ver Figura 3). Para no liarnos demasiado, las propiedades químicas de este compuesto hacen que tenga una coloración distinta en función del pH del medio, siendo una coloración entre rojiza y verdosa (según el tipo, G o R) a pHs ácidos, quedándose azul a pH neutro (pH = 7). La reacción entre el compuesto (se les suele llamar "sondas") y las proteínas presentes en una solución, o en este caso embebidas en el gel, hace que la forma mayoritaria sea la azul por el modo en que las cargas positivas y negativas se equilibran (esto es básicamente lo mismo que producen los cambios de pH). Por lo tanto, allí donde hay bandas azules es porque las proteínas han reaccionado con la sonda.

Figura 3. Estructura química del colorante Brilliant Blue R-250 (fuente). Nótese la presencia de grupos cargados positiva onegativamente, cuya carga dependerá del pH del medio, y en función del equilibrio entre cargas positivas o negativas la molécula tendrá unas propiedades espectrofotométricas u otras. Vamos, que cambiará de color.
Y ahora viene la parte curiosa: siempre me había preguntado quién era el tal Coomassie, y sobretodo, por qué tenía un nombre con tantas letras repetidas. Así que empecé una ardua investigación, que terminó en 35 segundos con una visita a la wikipedia. Allí descubrí, atónito, que Coomassie no es un señor sino un lugar. Un lugar donde una empresa textil desarrolló un colorante de gran eficiencia para teñir tejidos. Al reaccionar con las proteínas de la lana, se formaba ese azul tan bonito. Como los ingleses son tan así, en 1896 tomaron posesión de la ciudad de Coomassie, en Ghana (actual Kumasi), y le pusieron "en su honor" ese nombre al colorante. Al parecer la empresa textil fue luego adquirida por una compañía química que mantuvo la etiqueta "Coomassie" en todos los colorantes que desarrolló, hasta llegar al mencionado Brilliant Blue.
Así que Coomassie no era un señor. Pero existe otra técnica de tinción de proteínas, que se basa también en el color azul y por tanto implica este tipo de sondas. Veamos quién hay detrás.
El método de Bradford, también azul pero más feo
Este método se emplea para colorear proteínas en una solución líquida. El colorante se utiliza diluido en agua, y en función del pH tendrá un color que varía desde el anaranjado feo hasta el color netamente caca. Al añadir unas gotas de nuestra solución con proteínas (que puede provenir, por ejemplo, de un extracto celular), estas reaccionarán con la sonda, produciendo la ya familiar coloración azulada. En este caso, aunque la base de la técnica es la misma, sí podemos utilizarla cuantitavemente: es decir, en lugar de decir "vale, hay proteínas", podremos calcular qué concentración exacta de proteínas tenemos, gracias a que la coloración azul de esta solución tiene propiedades espectrofotométricas. ¡Ala, qué palabrota! Simplemente, significa que desviará la luz de una determinada longitud de onda de forma fácilmente medible en aparatos que todos tenemos en nuestros laboratorios (espectrofotómetros), y la desviará tanto más cuanto más azul sea: por tanto, cuantas más proteínas contenga. En realidad, en esto consiste el fenómeno del "color", en diferencias de desviación de sólo algunas de las longitudes de onda de entre todas las que componen la luz visible. Lo bueno de poder medir las longitudes de onda e sque podemos convertir esa "cantidad de color" en números, para poder ser precisos.
Figura 4. Preparando la solución de Bradford. En esta mezcla que nos muestra amablemente el compañero Arnaud, encontramos una quinta parte de colorante diluido en agua: puede apreciarse cómo la fase más acuosa varía visiblemente el color respecto al colorante concentrado. Al mezclarlo bien es cuando se queda el color cacuno.
Vayamos pues a la pregunta que a todos nos interesa: ¿era entonces Bradford un señor? Pues sí, esta vez el inventor del método era un tal Marion M. Bradford, cuyo artículo de 1976 donde explica el mencionado método es de los más citados en la historia de la bioquímica. Me hubiera gustado contaros más cosas sobre esta persona y el emocionante desarrollo de su método, pero al parecer debe de ser muy aburrido porque me he cansado de guglear sin encontrar nada de gran interés. Para ser sinceros, gran parte de la investigación ha recaído en averiguar si Marion era una señora o un señor, porque gracias las bondades de la lengua inglesa y la asexualidad de sus adejtivos por un lado, y por otro la casualidad de que "Marion" es nombre de chico o de chica, ha sido complicadísimo. Finalmente, en un artículo de rebote hablaban de Bradford y "HIS method", es toda la pista que he conseguido. Cualquier lector que pueda aportar datos interesantes de esta misteriosa persona, recibirá un premio qué va, no recibirá nada más que mi eterno agradecimiento.
Así que después de este pequeño despago, me encamino a hablaros del último método de colorines para pintar proteínas.
Rojo Ponceau, el favorito de Vlad Tepes
En este caso, el color es absolutamente inconfundible: un rojo precioso, que vertido sobre las fiambreras que contienen los geles da un aspecto sanguinolento de lo más turbador (por favor, no leáis estas últimas palabras demasiado seguidas). Se utiliza también para tener una idea cualitativa de si hay proteínas o no: en nuestro laboratorio solemos usarlo para teñir las membranas de polivinilo donde se transfieren las proteínas desde el gel de acrilamida, es decir, una especie de negativo del gel, como si fuese una fotocopia en un trocito de papel. Pero claro, por muy fotocopia, las proteínas siguen siendo incoloras: añadimos un poco de rojo Ponceau... et voilà! Ya vemos las típicas banditas.
Figura 5. Proceso de tinción de las membranas con rojo Ponceau: antes (izquierda) y después (derecha). Abajo, unas membranas previamente coloreadas y escaneadas, cortesía de nuestro compañero El Cheri (también conocido como "Manuel").
Esta sonda pertenece a un grupo muy diverso, muchas de ellas se utilizan como colorantes alimenticios y producen una coloración amarilla o rojiza. En concreta, la mencionada en este artículo correspondería con Ponceau S, también llamada "Acid red", rojo ácido. Lo bueno de esta tinción es que es reversible, y si se lava la membrana concienzudamente puede llegar a eliminarse del todo e incluso intentar utilizar anticuerpos para detectar específicamente las proteínas.
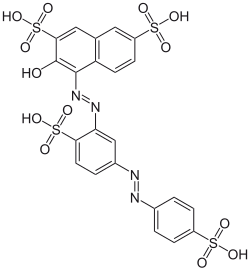
Figura 6. Estructura química de la sonda Ponceau S (fuente)
¿Y quién era Ponceau? ¿Un señor, una señora, un lugar? Pues no. Ponceau no era nada. Es una palabra francesa que define el color de las amapolas. "Rojo amapola", vamos. Decepcionante, ¿verdad?
Pues hasta aquí llegan mis pesquisas acerca de los nombres de estas soluciones tan comunes en el día a día de los embatados moleculares. Ha resultado algo frustrante, teniendo en cuenta las curiosas historias que hay detrás de algunos nombres en este campo (como la famosa tinción de Golgi de la que hablé aquí); no obstante, me alegra haber aprendido que Coomassie no es una persona sino un lugar, que Bradford era un señor con nombre de mujer y que Ponceau no era un investigador francés amante de los Bloody Marys, sino que es como debo llamar a las amapolas en Francia. Algo es algo.
Finalmente, la moraleja que debéis llevaros a casa es la siguiente: los caminos de la Ciencia son inexcrutables. Nadie sabe nunca de dónde pueden salir las aplicacions tecnológicas que den un vuelco al conocimiento científico. Así que nada de desdeñar cualquier tipo de investigación, ya sea en el campo textil, o en la industria alimentaria. Puede que de ahí nazcan algunos descubrimientos con una aplicación tan útil y cotidiana como la que nos han proporcionado estos colorantes de estructura química aromática y cualidades espectrofotométricas de lo más pintorescas.






Genial !
ResponderEliminarNo sabes las ganas que me han entrado de hacerme el listillo repelente con algún genio docente en su torre de marfil...
"¿Sabe usted de donde proviene el nombre de la tinción de Coomassie?" (risa maligna)
xD
Eso, a utilizar internet para lo que de verdad vale, para vacilar! ;D
EliminarGracias por pasarte y comentar, compañero!
Me ha encantado la reflexión final, y me recuerda a la charla que dió Shora en el Amazings-Nukas Bilbao 2012. Solo conocía el azul de Coomassie, que por cierto ya sería la repera que la m también fuera repetida, pero entonces sería italiana la cuiudad. Ah, la historia del rojo Ponceau no es nada decepcionante, creo que la más poética.
ResponderEliminarUna preguntilla, una vez tenéis la tinción hecha esas proteínas se pueden utilizar o quedan inutilizadas? (seguramente lo explicas en algún punto y me lo he saltado sin darme cuenta :S ). No sé, estaba pensando en la separación de proteínas en 2D que después "recortáis" las proteínas del gel; pero en las tinciones que explicas también podéis hacer lo mismo? ...se nota que soy de in silico, no?
El único caso en que la tinción es reversible es en el del Ponceau, algo he mencionado; se puede lavar la membrana y separar la sonda. Lo que pasa es que normalmente intentamos evitarlo, siempre se queda algo rojito y en realidad utilizamos esta tinción sólo para saber si la transferencia ha ido bien o no. En el caso del brilliant blue, aunque la coloración no se quita tan fácilmente, tampoco molesta para según qué tipo de análisis: se puede aislar las bandas y medir desintegraciones radiactivas si es un gel con isótopos, o mandar a espectrometría de masas. Cosas más finas como recuperar proteínas para un ensayo de actividad enzimática, pues como que no.
EliminarPero bueno, es una pregunta muy oportuna, de hecho yo mismo no tengo tan claro en qué casos podrían reutilizarse las muestras y en qué otros no. ¡Las visiones multidisciplinares siempre son bienvenidas! A ver si algún otro comentarista nos aporta más datos al respecto.
Gracias, más clarito :)
EliminarSuena bien lo de Coomassie, qué eufónico. A mí es que me sacas de los tintes de ADN y todo me suena nuevo.
ResponderEliminarAdemás viene muy bien para la sufrida broma de "voy a teñir un gel, así coomassie". De las mías, ya sabes.
EliminarA mí lo me ha gustado es la referencia a la "Liga de los HE". Es mi cómic favorito (con todas sus continuaciones) con mucho. Lo demás no lo he entendido ;)
ResponderEliminarMis compañeros de laboratorio que son tan majos me regalaron los dos primeros volúmenes para mi cumpleaños, así da gusto hombre.
EliminarPues yo sólo he leído estos dos (sublimes, sobretodo el segundo), así que ¿me recomiendas alguno más? No les tengo muy seguida la pista la verdad...
Por cierto, menudo divulgador de chicha y nabo estoy hecho... XD
Genial entrada Dr. Litos, como siempre.
ResponderEliminarSe te ha olvidado mencionar otro método tanto o más utilizado que el Bradford y tanto o más citado hasta el momento. Se usa menos porque es más engorroso pero he podido comprobar que es más exacto para medir concentración de proteínas. Se trata del método de Lowry. Primero se realiza la reacción o tinción con Biuret. Hecho a base de hidróxido potásico y sulfato cúprico junto con tartrato de sodio y potasio y da un color desde azulón hasta violeta (se que no mola tanto el color como el Coomassie, pero que le vamos a hacer). Por desgracia tampoco hay ningún señor o señora Biuret, el término se refiere a una familia de compuestos orgánicos con el grupo -(HN-CO-)2N-. Por ejemplo el Dimetilbiuret es CH3HN-CO-NR'-CO-NHCH3.
Después con el reactivo de Folin-Ciocalteu todos juntos hacen la reacción que vira a azulón y también es cuantificable con palabrotas como Espectrofotometría.
Por otro lado, Marion M. Bradford (si, es un señor) ha sido citado por su tinción por más de 167757 autores. Desde que apareció solo ha decaído en 2011 (y mucho me temo que se debe a una bajada en la producción científica de artículos)
Sin embargo el másssssss citado de todos es este:
"Protein measurement with the Folin Phenol Reagent. It was authored by Oliver H. Lowry, Nira J. Rosebrough, A. Lewis Farr and Rose J. Randall."
El famoso Método de Lowry. con 185500 y pico citas.
Respecto al a vida de Bradford, efectivamente debió de ser muy triste porque yo tampoco he encontrado nada que merezca la pena.
Colera, pedazo de contribución al post! Es cierto, cómo se me pudo olvidar el Lowry... será porque yo no lo hago nunca. Sí pensé comentar la tinción de plata, al final decidí centrarme en lo que mejor conocía y si acaso hacer un segundo post o dejarlo para los comentarios. Pero de verdad que el Lowry se me pasó totalmente.
EliminarGracias por la aportación, ¡y sobretodo por explicarla tan bien! De verdad que con comentaristas así da gusto oiga...
Te has dejado dos:
ResponderEliminar-La tinción de plata para proteínas, normalmente para puntos de bidimensional que luego se manden a analizar.
-y la de BCA (http://en.wikipedia.org/wiki/Bicinchoninic_acid_assay), que es de rutina en mi labo, aunque yo suelo usar más el Bradford porque me da en el margen de mis muestras de proteínas habituales.
Como le decía a Oskar más arriba, la de plata me la dejé aposta, porque la intención original del post era buscar el porqué de esos nombres y quién estaba detrás de estos métodos.
EliminarPero se agradece el apunte, porque la de BCA no la conocía. Si ya lo decía yo, menudos comentaristas más cultivados y pofesionales que tengo.
como se ve con amido negro o tinta china ?
ResponderEliminar